Documentación Técnica
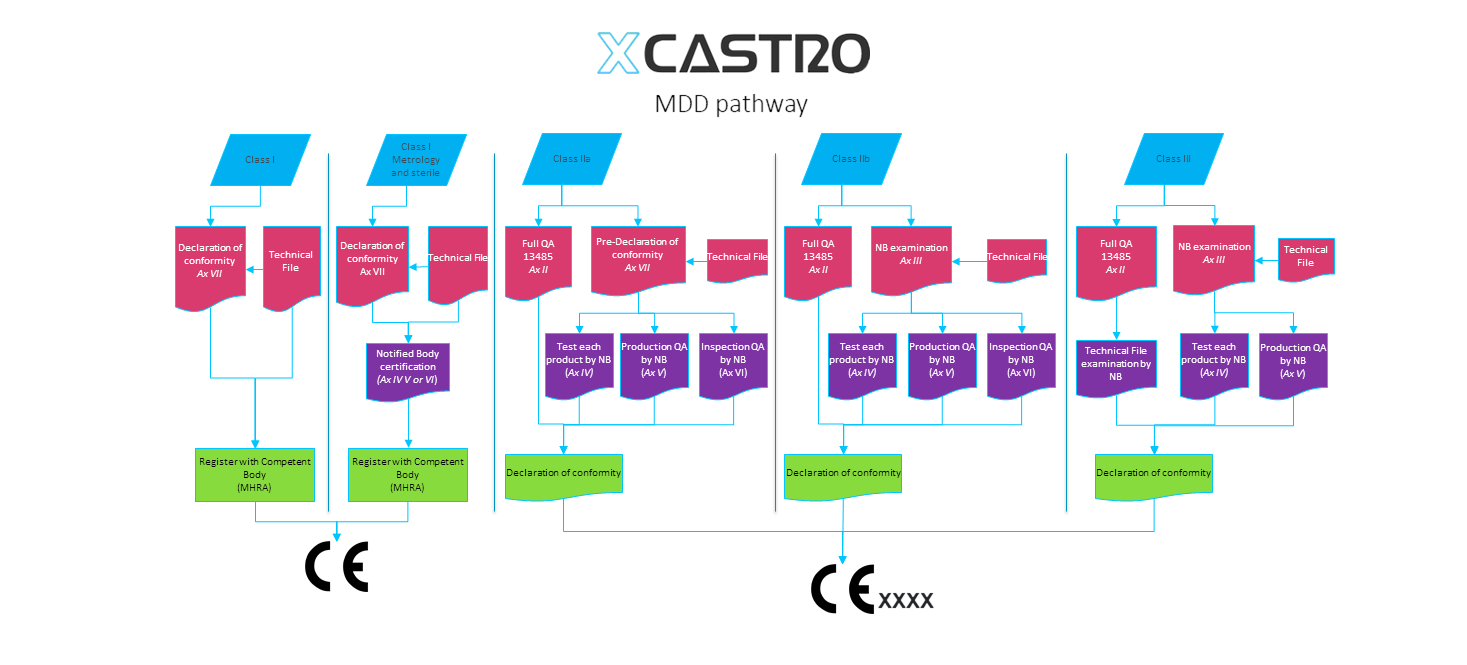
Para exportar productos a algunos países como la Comunidad Europea es necesario contar con un expediente técnico que describa el producto y demuestre que es seguro y cumple con las normas necesarias. En el caso de productos médicos, los requisitos son más estrictos y es obligatorio en todos los países industrializados.
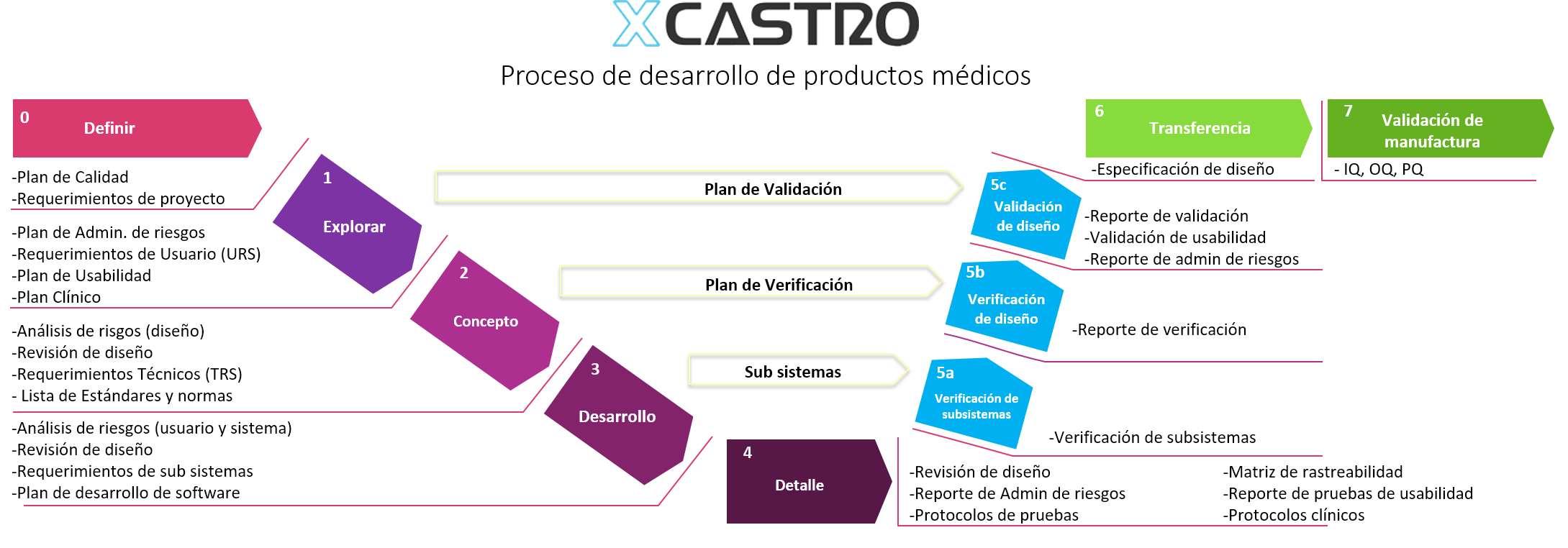
Parte importante del proceso de diseño y desarrollo de producto, es el crear un expediente técnico con la documentación necesaria que demuestre que el producto es seguro de usar y cumple con las normas necesarias. La mejor manera para crear esta documentación es hacerlo durante el proceso de desarrollo. El dejarlo para el final puede implicar que partes del producto tengan que ser rediseñadas o requerir procesos complejos de pruebas o justificaciones para comprobar que el producto cumple con las normas y aspectos de seguridad necesarios.
Mi proceso de diseño planea la creación de documentación técnica durante el proceso de desarrollo del producto. De esta manera, el compilar el expediente técnico se vuelve una tarea sencilla. Los documentos están planeados de manera que la justificación del diseño se realiza conforme el producto evoluciona, poniendo especial atención a la administración de riesgos durante cada etapa del desarrollo.
Administración de riesgos 14971
Para el desarrollo de productos médico es necesario crear un expediente de administración de riesgos que demuestre que el producto es seguro de usar. El proceso que sigo se apega a la norma ISO 14971, la cual se divide en 6 partes:
1) Análisis de riesgos
2) Evaluación de riesgos
3) Control de riesgos
4) Evaluación de riesgos residuales
5) Reporte de administración de riesgos
6) Información de producción
Diferentes herramientas se pueden utilizar para en análisis y evaluación de riesgos, la más común es Análisis de Modos de Falla y sus Efectos (FMEA Failure Mode and Effect Analysis). Esta herramienta nos sirve para identificar la severidad de cada riesgo para evaluar su efecto y establecer acciones que mitiguen el riesgo.
Análisis de modos de falla y sus efectos (FMEA)
Como parte del proceso de desarrollo que sigo, utilizo constantemente FMEAs para evaluar conceptos y diseños y asegurarnos que todos los posibles riesgos hayan sido atendidos cuando el diseño haya sido definido.
En mi proceso utilizo diferentes FMEAs, cada uno sirve en diferentes etapas del desarrollo y nos permite analizar diferentes aspectos del producto. La siguiente lista describe brevemente los más comunes.
- Concept FMEA – Evaluate ideas
- System FMEA – High level functions
- Design FMEA – Components and features
- Usability FMEA – User interaction
- Software FMEA - Algorithms
- Process FMEA – Manufacturing
Apoyándote
Como parte de mis servicios, apoyo a empresas y consultores en México en el la creación y compilación de expedientes técnicos y el análisis de riesgo de productos médicos.